董 浩,原 霖,刘 洋,徐 阳,陈亚娜,沈子莹,梁春南
(1.中国食品药品检定研究院,北京 102600;
2.中国动物疫病预防控制中心,北京 102600)
我国目前使用的布病疫苗主要有布鲁菌A19疫苗、布鲁菌S2疫苗和布鲁菌M5疫苗。其中布鲁菌A19疫苗常用于牛的免疫,该疫苗一般采用皮下注射的方式对3~8月龄牛接种,必要时可以1/60的剂量在第1次配种前(18~20月龄)加强免疫,保护期可以长达72个月。由于牛种布鲁菌毒力较弱,且采用注射免疫的方式疫苗液暴露风险低,对防疫人员的安全较高。但是,A19疫苗不能免疫怀孕牛,否则会造成动物流产的严重后果[1-3]。
血清学检测方法是动物布病检测的主要方法,但是现有血清学检测方法与大肠杆菌O157和耶尔森菌O9存在交叉反应。除此之外,由于我国目前使用的布病疫苗(A19、S2和M5)都具有与野毒株一样的完整脂多糖结构,所以现有的血清学检测方法无法对我国使用的A19布病疫苗的免疫抗体和自然感染抗体进行区分[4]。
和国外的S19疫苗不同,我国使用的布鲁菌病A19疫苗并不存在ery操纵子序列的缺失,因此无法使用Bruce-Ladder PCR进行鉴别[5]。2020年,WANG等[6]对A19疫苗全基因组序列的测通,使得分析布鲁菌A19疫苗株和其他布鲁菌基因组水平的差异成为可能。基于这些特异性的差异序列,建立相应的荧光定量PCR方法对布鲁菌A19疫苗株进行鉴别,将对于布病的鉴别诊断和综合防控具有重要意义。
1.1 菌株与基因组模板羊种布鲁菌16M、牛种布鲁菌2308、猪种布鲁菌1330、犬种布鲁菌RM6/66、布鲁菌A19疫苗株和布鲁菌S2疫苗株的基因组均由国家动物布鲁菌病参考实验室惠赠;
大肠杆菌、鼠伤寒沙门菌、金黄色葡萄球菌、无乳链球菌和小肠结肠炎耶尔森菌均由本实验室保存。
1.2 主要试剂与仪器细菌基因组DNA提取试剂盒购自西安天隆科技有限公司;
琼脂糖凝胶回收试剂盒和质粒提取试剂盒均购自Omega公司;
GoTag Probe qPCR Master Mix购自Promega公司;
BamHⅠ和KpnⅠ限制性内切酶以及T4连接酶购自NEB公司;
TE缓冲液购自北京索莱宝科技有限公司;
GeneRotex全自动旋转式核酸提取仪和Gentier 96E全自动医用PCR分析系统购自西安天隆科技有限公司;
NanoDrop2000购自赛默飞世尔科技(中国)有限公司。
1.3 引物探针的设计根据GenBank公布的羊种布鲁菌16M、牛种布鲁菌2308、猪种布鲁菌1330、犬种布鲁菌RM6/66、布鲁菌A19疫苗株和布鲁菌S2疫苗株基因组序列,针对A19疫苗株特有的缺失序列,设计了1对特异性引物和1条探针(A19-F、A19-R和A19-Probe),用于鉴别A19疫苗株与其他布鲁菌菌株。参照文献[7]设计的BCSP31特异性引物和探针作为检测布鲁菌的通检引物和探针(Bru-F、Bru-R和Bru-Probe)。引物和探针均由生工生物工程(上海)股份有限公司合成,具体序列见表1。

表1 引物和探针序列
1.4 质粒标准品的制备针对牛种布鲁菌A19疫苗株特异性的缺失序列,设计相应的特异性扩增引物(表1)。以牛种布鲁菌2308株为模板,扩增长度为258 bp的目的片段。PCR扩增程序:94℃ 5 min;
94℃ 30 s,55℃ 30 s,72℃ 30 s,共30个循环;
72℃ 10 min。回收电泳大小正确的目的扩增片段,经过BamH Ⅰ和Kpn Ⅰ双酶切后,克隆入pUC19载体。挑取PCR检测为阳性的克隆送生工生物工程(上海)股份有限公司进行测序。获得的阳性质粒命名为pUC-A19。将含有pUC-A19目的质粒的感受态菌株,使用含有氨苄青霉素的TSB液体培养基培养至稳定期后,使用质粒小提试剂盒进行质粒提取。利用Nanodrop 2000对质粒浓度进行测定,计算拷贝数。采用TE缓冲液对标准品质粒进行适当倍数的稀释。
以牛种布鲁菌标准株2308株为模板,PCR扩增布鲁菌保守的BCSP31插入序列中长度为856 bp的目的片段,引物序列见表1。PCR扩增程序:94℃ 5 min;
94℃ 30 s,55℃ 30 s,72℃ 60 s,共30个循环;
72℃ 10 min。回收目的扩增片段,经过BamHⅠ和KpnⅠ双酶切后,克隆入pUC19载体。挑取PCR检测为阳性的克隆送生工生物工程(上海)股份有限公司进行测序。获得的阳性质粒命名为pUC-BCSP31。将含有pUC-BCSP31目的质粒的感受态菌株,使用含有氨苄青霉素的TSB液体培养基培养至稳定期后,使用质粒小提试剂盒进行质粒提取。利用Nanodrop 2000对质粒浓度进行测定,计算拷贝数。采用TE缓冲液对标准品质粒进行适当倍数的稀释。
1.5 反应条件的优化按照GoTag Probe qPCR Master Mix的试剂使用说明书配置20 μL反应体系,包括10 μL 2×GoTaq®Probe qPCR Master Mix、引物、探针、模板和水。用矩阵法进行双重荧光定量PCR,筛选引物和探针的最佳搭配浓度。
1.6 特异性试验分别以大肠杆菌、鼠伤寒沙门菌、金黄色葡萄球菌、无乳链球菌和小肠结肠炎耶尔森菌等灭活细菌核酸为模板进行双重荧光定量PCR 检测,并设置1个牛种布鲁菌标准株2308核酸阳性对照和1个空白对照(水)。同时,分别以羊种布鲁菌16M、牛种布鲁菌2308、猪种布鲁菌1330、犬种布鲁菌RM6/66、布鲁菌A19疫苗株和布鲁菌S2疫苗株灭活细菌核酸为模板进行双重荧光定量PCR检测,同时设置1个空白对照(水)。
1.7 标准曲线的绘制分别将1.4构建的质粒标准品pUC-BCSP31和pUC-A19做10倍梯度稀释,模板为浓度是1×106,1×105,1×104,1×103,1×102拷贝/μL的质粒标准品,进行双重荧光定量PCR检测,用Gentier 96E全自动医用PCR分析系统配套软件绘制标准曲线。
1.8 敏感性试验分别将1.4构建的质粒标准品pUC-BCSP31和pUC-A19做10倍梯度稀释,模板为浓度是1×105,1×104,1×103,1×102,1×101,1×100拷贝/μL的质粒,每个稀释度做3个重复,进行双重荧光定量PCR检测,以测定该双重荧光定量PCR方法的敏感性。
1.9 重复性试验分别采用浓度为1×106,1×104,1×102拷贝/μL的质粒标准品进行双重荧光定量PCR检测,每个浓度的模板分别进行批内重复和批间重复试验3次,以评估所建立方法的重复性。
1.10 临床样品检测分别采用建立的双重荧光定量PCR方法,对国家动物布鲁菌病参考实验室惠赠的92份临床流产奶牛阴道拭子核酸样品(对应牛的布病血清检测均为阳性)和本实验室收集的30份A19疫苗皮下注射免疫(6×1010CFU/头)的3月龄犊牛血液的核酸样品进行检测。同时,用现行行业标准《奶牛布鲁菌病PCR诊断技术》(NY/T 1467-2007)的套式PCR方法和Bruce-Ladder PCR方法对上述样品进行检测。
2.1 重组质粒标准品的鉴定以牛种布鲁菌标准株2308株为模板,PCR扩增布鲁菌保守的BCSP31插入序列和A19疫苗株缺失序列,PCR产物经过电泳后,分别在856,258 bp出现和预期相符的目的条带。2种PCR产物回收后分别克隆入pUC19载体,经过PCR鉴定和测序分析发现,2个重组质粒(pUC-BCSP31和pUC-A19)构建成功。
2.2 反应条件的优化结果及标准曲线的建立通过体系优化,双重荧光定量PCR的最佳反应体系为GoTaq®Probe qPCR Master Mix 10 μL,10 μmol/L的上、下游引物各 0.6 μL,10 μmol/L的探针各0.6 μL,DNA 模板 2 μL,加入无核酸酶的水补齐 20 μL。
反应程序确定为95℃ 2 min;
95℃ 15 s,60℃ 1 min,40 个循环。每个循环第 2 步,60℃ 1 min,分别收集FAM和VIC荧光信号。
将pUC-BCSP31和pUC-A19标准品质粒分别进行10倍倍比稀释后作为模板,采用优化好条件的双重荧光定量PCR进行扩增。结果显示,在1×106~1×102拷贝/μL的质粒标准品作为模板时,布鲁菌BCSP31通检荧光的E= 90.954%,R2值为0.997(图1A);
布鲁菌A19疫苗缺失序列荧光的E=101.256,R2值为0.999(图1B)。
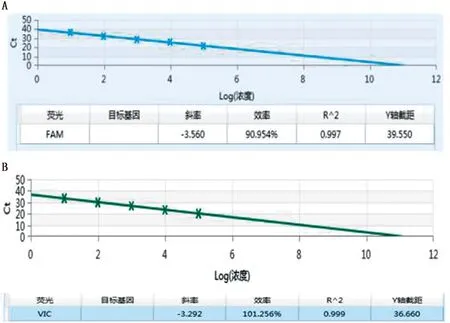
A.使用pUC-BCSP31标准品绘制的标准曲线;
B.使用pUC-A19标准品绘制的标准曲线
2.3 特异性试验分别以羊种布鲁菌16M、牛种布鲁菌2308、猪种布鲁菌1330、犬种布鲁菌RM6/66、布鲁菌A19疫苗株、布鲁菌S2疫苗株、大肠杆菌、鼠伤寒沙门菌、金黄色葡萄球菌、无乳链球菌和小肠结肠炎耶尔森菌的核酸作为模板,同时以ddH2O为阴性对照,采用优化好条件的双重荧光定量PCR进行扩增。结果显示,布鲁菌A19疫苗株出现1条S型特异性扩增曲线(图2A),羊种布鲁菌16M、牛种布鲁菌2308、猪种布鲁菌1330、犬种布鲁菌RM6/66、布鲁菌S2疫苗株出现2条S型特异性扩增曲线,受篇幅限制只展示羊种布鲁菌标准株16M和牛种布鲁菌标准株2308核酸的扩增曲线(图2B,C)。非布鲁菌的其他细菌核酸样品均未出现特异性的扩增曲线。
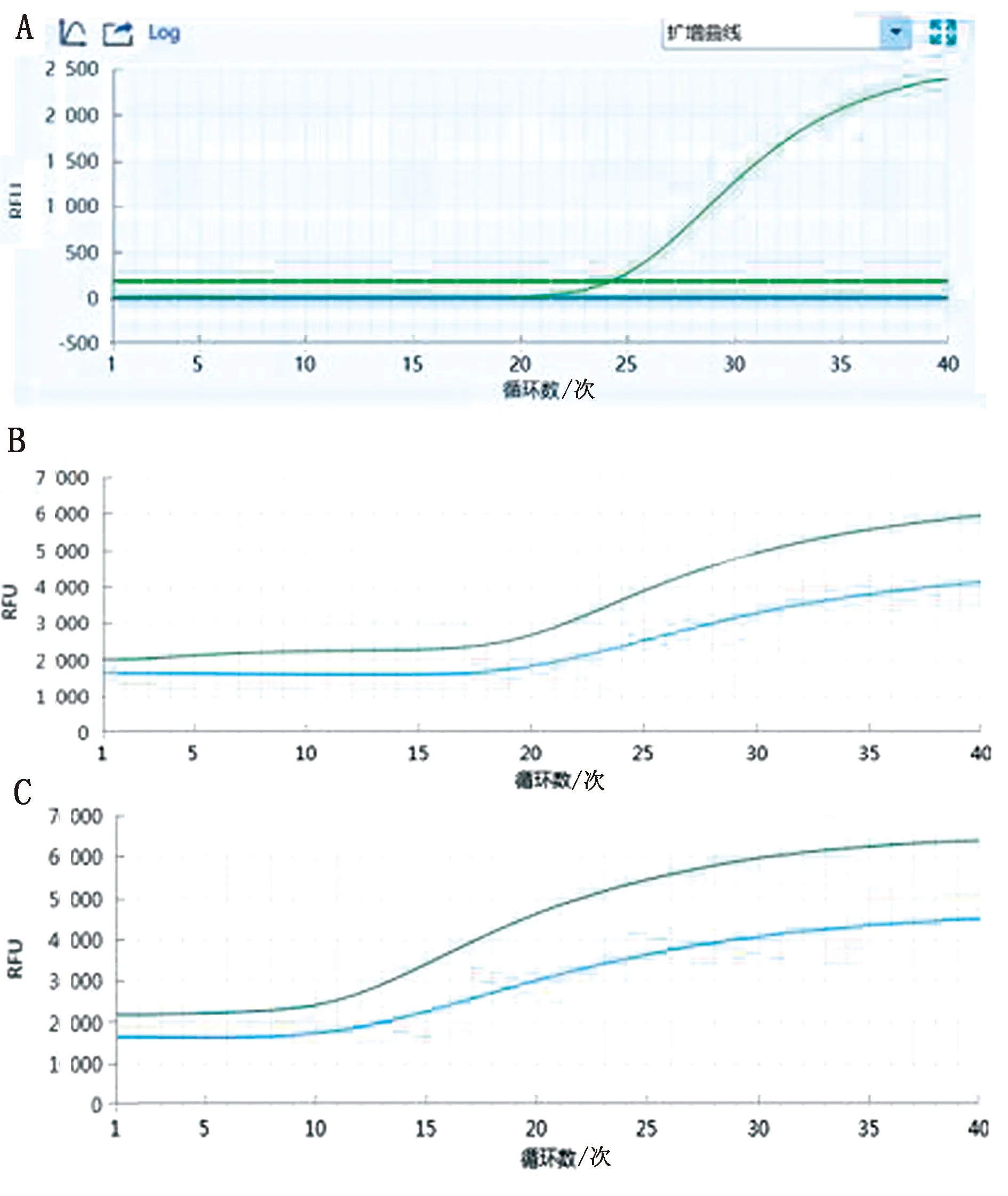
A.A19疫苗株核酸的扩增曲线;
B.羊种布鲁菌标准株16M核酸的扩增曲线;
C.牛种布鲁菌标准株2308核酸的扩增曲线
2.4 敏感性试验为了测试双重荧光定量PCR的敏感性,将pUC-BCSP31和pUC-A19标准品质粒分别进行10倍倍比稀释后作为模板,采用优化好条件的双重荧光定量PCR进行扩增。结果显示,布鲁菌BCSP31通检荧光的最低检测限为1×101拷贝/μL,布鲁菌A19疫苗缺失序列荧光的最低检测限为1×101拷贝/μL(图3)。
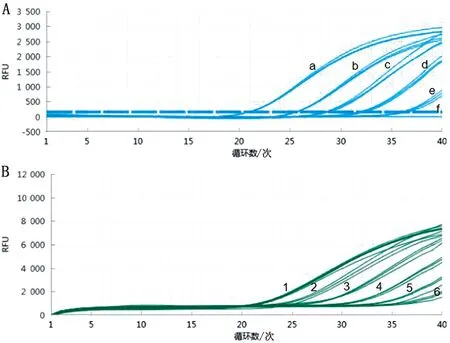
A.a~g分别为1×106~1×100拷贝/μL的pUC-BCSP31标准品扩增结果;
B.1~6分别为1×106~1×100拷贝/μL的pUC-A19标准品扩增结果
2.5 重复性试验分别采用浓度为1×106,1×104,1×102拷贝/μL的2种质粒标准品进行了组内重复和组间重复试验,结果如表2所示,组内和组间的变异系数(CV)均小于3%,这说明所建立的双重荧光定量PCR具有良好的重复性。
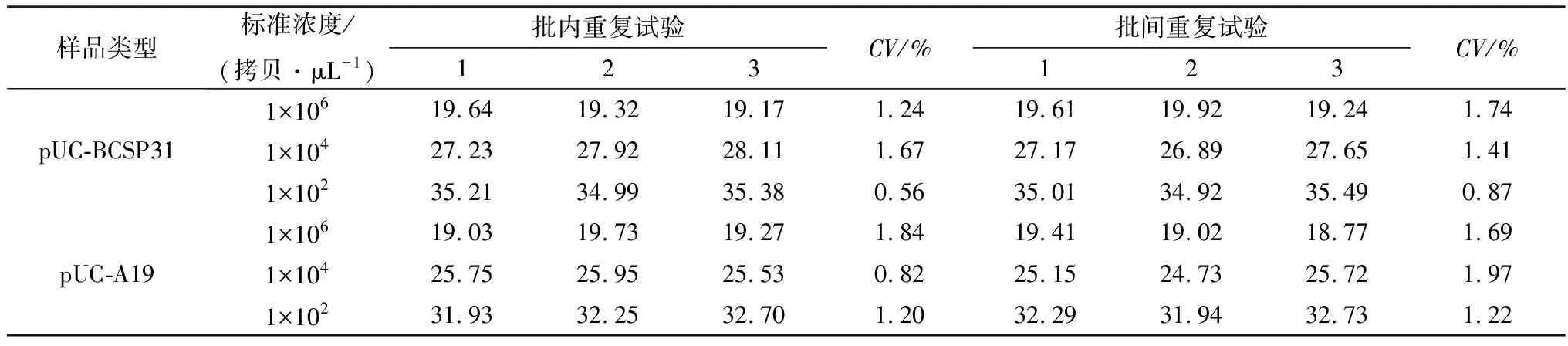
表2 双重荧光定量PCR的批内和批间重复试验结果(Ct值)
2.6 临床样品检测结果利用建立的双重荧光定量PCR对国家动物布鲁菌病参考实验室惠赠的92份临床流产奶牛阴道拭子核酸样品和本实验室收集的30份A19疫苗注射免疫的犊牛血液的核酸样品进行检测。结果表明,92份临床流产奶牛阴道拭子样品,双重荧光定量PCR检出87阳性(均为含有非A19疫苗株的布鲁菌核酸,不排除样品中同时含有A19疫苗株核酸),套式PCR检测出53份布鲁菌核酸阳性,Bruce-Ladder PCR检测出11份样品羊种布鲁菌阳性。30份A19疫苗免疫的犊牛血液核酸样品,双重荧光定量PCR检出8阳性(均为A19疫苗株),套式PCR检测出5份布鲁菌核酸阳性,Bruce-Ladder PCR检测出0份布鲁菌阳性(表3)。
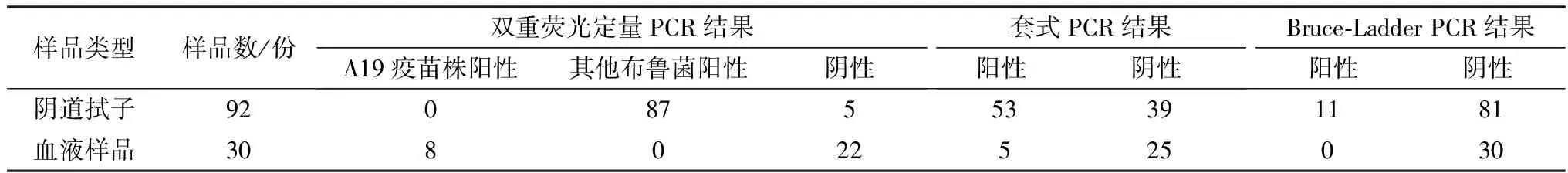
表3 双重荧光定量PCR、套式PCR和Bruce-Ladder PCR检测临床样品的比较
由于我国目前使用的A19布病疫苗与我国布病流行株均属于光滑型布鲁菌菌株,使得在使用该疫苗免疫家畜后无法对免疫抗体和自然感染抗体进行鉴别诊断。根据《布鲁菌病防治技术规范》的规定,为了排除疫苗免疫抗体的干扰,接种过A19疫苗的动物,在接种后18个月(猪接种后6个月)才能通过血清学检测判定动物是否感染野毒菌株。但是如此长的时间周期显然不利于尽快剔除群体中的感染动物。
PCR方法是家畜布鲁菌病诊断的一种重要方法,在现行的国家标准《动物布鲁菌病诊断技术》(GB/T18646-2018)和行业标准《奶牛布鲁菌病PCR诊断技术》(NY/T 1467-2007)中分别提供了可用于布鲁菌检测的Bruce-Ladder PCR方法和套式PCR方法。然而,这2种方法都存在一定的缺陷。Bruce-Ladder PCR虽然可以进行布鲁菌的分型,但是由于该方法敏感性偏低,仅能在分离到布鲁菌后才可以应用,无法直接应用于临床样品中布鲁菌核酸的检测,这就极大地限制了该方法的应用范围。而且该方法能够分型的疫苗株均为国外应用的疫苗株,并不适用于我国现有的疫苗株(S2、A19和M5株)的分型。套式PCR虽然敏感性较高(但仍低于荧光定量PCR方法),可以直接对临床样品进行检测,但是该方法只是一种布鲁菌的通检方法,无法进行分型和疫苗株的鉴别。因此,迫切需要一种敏感性高并且可以适用于我国疫苗株鉴别诊断的PCR检测方法。
随着新一代测序技术的发展,大量布鲁菌的全基因组序列被测通和上传到GenBank数据库,这使得通过比较基因组学筛选疫苗株特定的检测靶点成为可能。王姝懿等[8]完成了A19疫苗株的全基因组测序,并进行了相关的比较基因组学分析。谭鹏飞等[9]运用生物信息学对A19疫苗株的基因组进行了分析,发现在A19和S19疫苗株中,ClpX G825-C825、LysR A605-C605、Omp2b G503-A503这3个SNP位点为这2个菌株的特异性SNP位点,可用于对上述2个菌株进行鉴别诊断。基于这些特异性的SNP位点,研究者们建立了相应的A19/S19的鉴别诊断方法。NAN等[10]基于A19和S19菌株特异的SNP位点,建立了相应的cycleave PCR鉴别方法,该方法对A19疫苗株核酸的最低检测限是7.6 fg,对其他布鲁菌菌株核酸的最低检测限是220 fg。
和上述研究相比,本研究同样也是基于A19疫苗株特有的缺失序列设计了1套对A19疫苗株进行鉴别的引物和探针,配合布鲁菌BCSP31通检引物探针,实现对A19疫苗株的鉴别诊断。而本研究建立的方法最大的优点在于仅需使用常规的TaqMan探针和通用的荧光定量PCR试剂,而不需要像cycleave PCR等方法购买试剂盒,大大降低了试剂成本,更有利于该方法在分子检测实验室的应用与推广。
综上所述,本研究建立了一种可以对布鲁菌A19疫苗株进行鉴别诊断的双重荧光定量PCR方法,敏感性、特异性和重复性较好,对于临床样品检测效果也明显优于目前我国农业行业标准中规定的套式PCR方法和国家标准中推荐的Bruce-Ladder PCR方法。因此,该方法可用于临床家畜组织样品A19疫苗株与其他布鲁菌属的鉴别检测,对我国布病的早期诊断和综合防控具有重要意义。
猜你喜欢 质粒双重定量 基因工程中载体概述中学生物学(2022年8期)2022-10-13——一道江苏高考题的奥秘解读和拓展">农杆菌转化法中的“Ti质粒转化载体系统”的简介——一道江苏高考题的奥秘解读和拓展中学生物学(2022年7期)2022-09-07有机物官能团的定量关系在解题中的应用中学生数理化·高一版(2022年4期)2022-05-09开发新方法追踪植物病害的全球传播(2020.6.7 iPlants)三农资讯半月报(2020年11期)2020-06-21小鼠转录因子STATl真核表达质粒的构建及生物学功能分析江苏农业学报(2019年1期)2019-09-10语文阅读课堂教学流程的双重逻辑福建基础教育研究(2019年7期)2019-05-28分析师关注对财务重述的双重作用智富时代(2019年2期)2019-04-18分析师关注对财务重述的双重作用智富时代(2019年2期)2019-04-18形成初步定量思维。做好初高中化学衔接学习中学生数理化·高一版(2016年8期)2016-12-07学写双重否定句作文周刊·小学一年级版(2016年4期)2016-08-11